Reakčná rovnica
V chémii používaš Reakčné rovnice, symbolicky predstavovať reakciu medzi rôznymi látkami. V tomto príspevku vám ukážeme, ako môžete nastaviť takúto reakčnú rovnicu.
Prajete si, aby bola celá vec stručne a výstižne vysvetlená vo videu? Potom sa mrknite tu Vstúpte.
Reakčná rovnica je vysvetlená jednoducho
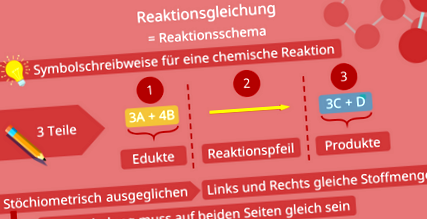
Chemické látky môžu vzájomne pôsobiť reagovať a transformované na iné zlúčeniny. V chémii môžete nazvať takúto reakciu Reakčná rovnica zastupovať. Toto sa tiež často nazýva Schéma reakcie určený. Vľavo napíšete svoje počiatočné materiály a konečný výsledok zobrazíte príslušnými symbolmi prvkov vpravo. Potom obe strany spojíte šípkou, ktorá označuje smer reakcie.
Mali by ste sa tiež ubezpečiť, že reakčná rovnica je správna stechiometrický je nastavený. To znamená, že na ľavej strane rovnice je rovnaké množstvo látok ako na pravej strane. Tiež musí Celkový poplatok byť rovnaké na oboch stranách. Východiskové materiály, t. J. Materiály na ľavej strane rovnice, sa nazývajú východiskové materiály a konečný výsledok sa nazýva výrobky.
Reakčné rovnice
V reakčných rovniciach Vychováva a Produkty sú navzájom v rovnakom stechiometrickom pomere. Takže vľavo od rovnice musí byť toľko atómov, ako vpravo. Na dosiahnutie tohto cieľa existuje stechiometrické čísla. Pretože tieto čísla sú v reakčnej rovnici pred látkou, bude to isté stechiometrické koeficienty zavolal.
Stechiometrické koeficienty
The Koeficienty sú pred príslušným atómom alebo molekulou a označujú, koľko látky je potrebné na reakciu. Číslo 1 nie je napísané. Stechiometrické číslo môže byť tiež v Jednotka kr byť interpretovaný. V kapitole o spaľovaní metánu sa na koeficient pozrieme na príklade.
index
K dispozícii je tiež index v reakčnej rovnici. Udáva, koľko rovnakých atómov je v molekule viazaných. Musíte však byť opatrní, aby ste pri nastavovaní reakčnej schémy nič nezmenili na indexe molekuly. Inak by došlo k inej súvislosti a teda k úplne inej podstate. Ak chcete zmeniť množstvo v chemickej rovnici, vždy použite stechiometrický Koeficienty.
Horiaci metán
Pri a spaľovanie východiskový materiál reaguje s kyslíkom a voda sa vytvára ako vedľajší produkt. Náš východiskový materiál, ktorý by sa mal spáliť, je molekula metánu.
CH4 + 2 O2 CO2 + 2 H2O
metán (CH4) má v tejto rovnici chemickej reakcie stechiometrické číslo. Nemusí sa to písať. Okrem toho má vodík index 4. To znamená, že k jednému atómu uhlíka sú viazané 4 rôzne atómy vodíka.
V Ukážka reakcie Pre jeden metán (CH4) sú na spaľovanie potrebné dve molekuly kyslíka (O2). Vidíte, že na pravej strane existujú aj štyri atómy kyslíka v dôsledku molekuly oxidu uhličitého (CO2) a dvoch molekúl vody (H20). Atómy kyslíka medzi reaktantmi a produktmi sú rovnaké a teda vyvážené. Počet atómov uhlíka (C) a atómov vodíka (H) je tiež rovnaký vľavo a vpravo.
Reakčnú rovnicu nájdete tiež v Jednotka kr vykladať. Jeden mól metánu reaguje s dvoma mólmi kyslíka za vzniku jedného mólu oxidu uhličitého a dvoch mólov vody.
Reakčná šípka
Existujú aj rôzne v reakčnej rovnici Reakčné šípky, ktoré môžete použiť v rovniciach chemických reakcií. Na jednej strane je normálna šípka, ktorá ukazuje smer reakcie. V príklade nižšie môžete vidieť, že dva atómy sodíka a jedna molekula chlóru reagujú za vzniku dvoch častíc chloridu sodného.
2 Na + Cl2 2 NaCl
Reakcia prebieha zľava doprava.
Môžete tiež použiť tzv Rovnovážne reakcie mapa s dvojitou šípkou.
I2 + H2 2 HI
Reakcia tu nie je úplne jednosmerná. Jód reaguje s vodíkom za vzniku jodidu vodíka, ale tiež sa rozkladá na svoje zložky. Chemická reakcia prebieha zľava doprava a sprava doľava. V článku o zákone o hromadnej akcii si ukážeme, ako sa chemikália používa rovnováha reakčná rovnica sa dá určiť a dokonca presnejšie vypočítať.
Stanovte reakčnú rovnicu
Existujú rôzne Typy reakčných rovníc v chémii. Niektoré môžu byť redoxné reakcie, spaľovanie, substitúcia, acidobázická reakcia alebo zrážanie. Všetky tieto majú odlišné charakteristiky a bežať rôznymi spôsobmi. Napríklad východiskový materiál počas spaľovania vždy reaguje s kyslíkom a vedľajším produktom je vždy voda.
Preto je to veľmi ťažké všeobecný postup na nastavenie reakčných rovníc. Zhruba však vždy môžete vykonať nasledujúce kroky, aby ste sa priblížili k skutočnej rovnici.
Na jednej strane môžete definovať rôznych reakčných partnerov a určiť, čo reaguje ako východiskový materiál a ktorá látka je výsledkom. Môžete to urobiť v takzvanej chemikálii Slovná rovnica drž sa pevne. Slovná rovnica by bola napríklad:
Vodík + kyslík voda
Môžete tiež okamžite určiť šípku tak, že si položíte otázku, ktorá z nich Usmernite reakciu alebo či ide o rovnovážnu reakciu. V našom prípade vodík reaguje s kyslíkom za vzniku vody.
Teraz môžete previesť slovo rovnica na Symbolický zápis prepočítajte pre reakčnú rovnicu. Jednoducho použijete symboly prvkov látok.
H + O H20
Teraz to musíte vedieť vodík nevyskytuje sa jednotlivo a kyslík za normálnych podmienok existuje aj ako spojenie medzi dvoma atómami kyslíka. Výsledkom by bolo:
H2 + O2 H2O
Vyvážte reakčnú rovnicu
The Reakčná rovnica stále musíte bilancovať stechiometricky. To znamená, že počet atómov musí byť rovnaký vpravo a vľavo.
Pre vodík to by bola tiež pravda, iba s kyslík Bohužiaľ nie. Vľavo od eduktov sú dva atómy a iba jeden z produktov.
Potrebujete dva atómy kyslíka na pravej strane, takže pred vodu napíšeme 2 ako stechiometrické číslo.
H2 + O2 2 H2O
Kedy Výsledok v reakčnej rovnici je príliš veľa vodíka. Dva atómy vodíka nemôžu tvoriť štyri. Musíte to kompenzovať a výsledok je:
2 H2 + O2 2 H2O
To by bola stechiometrická vyvážená reakčná rovnica. The poplatok tu nemusíte kompenzovať, pretože všetky atómy sú prítomné s neutrálnym nábojom.
Príklady reakcií
V tejto časti vám ukážeme niekoľko dôležitých Reakčné rovnice na.
Jednou z najdôležitejších rovníc je rovnica fotosyntéza . Oxid uhličitý (CO2) reaguje s vodou (H2O) za vzniku glukózy (C6H12O6) a kyslíka (O2):
6 CO2 + 6 H20 C6H12O6 + 6 O2
Musíte rátať s tým, že reakcie sa dajú dosiahnuť iba pomocou svetlo vyprší.
Okolo Stolová soľ Na výrobu (NaCl) potrebujete sodík (N) a chlór (Cl).
2 Na + Cl2 2 NaCl
Pre amoniak (NH3) potrebujete dusík (N) a vodík (H):
N2 + H2 NH3
Výroba kovových železo (Fe) sa vyskytuje prostredníctvom prirodzene sa vyskytujúceho oxidu železa (Fe2O3), ktorý reaguje s oxidom uhoľnatým (CO) za vzniku železa a oxidu uhličitého.
Fe2O3 + 3 CO 2 Fe + 3 CO2
Ukážeme vám tiež reakčnú rovnicu pre a Fehlingova vzorka v tomto videu .
Ďalšie informácie o reakčnej rovnici
V Reakčná rovnica môžu byť uvedené v zátvorkách za príslušnými prvkami List stáť. Toto vám povie, v akom agregovanom stave je prvok. Tu l znamená tekutý, g plynný a s tuhý.
Aplikované na našu príkladnú reakciu by vyzeralo takto:
Plynný vodík a kyslík reagujú za vzniku kvapalnej vody.
- Test napájania PC ATX pomocou multimetra alebo testera napájania; Test 3,3 V 5 V 12V; s videom; Tuhl
- Mexite; Na váhach; Rezné pole; Video; grafický
- Nové video Chubby dostane fit - vlog! Bucľatá dostane fit
- Schudnite rýchlo za týždeň video, tipy a nápady SAT
- Online komentár zachraňuje životy detí - video